מדובר בחומצת אמינו שהגוף מייצר אך התגלתה למדע רק בשנת 1986
למעט מספר חריגים, כל החלבונים הידועים לנו מורכבים מעשרים חומצות אמינו בלבד. לפני 25 שנים מדענים גילו את החומצה העשרים ואחת – סלנוציסטאין, ולפני עשור את החומצה העשרים ושתיים – פירוליזין. אולם, המנגנון שבו התא מייצר את אבני הבניין הנדירים הללו נותר עלום עד כה. כעת, חוקרים מגרמניה הצליחו לחשוף את מבנהו של אנזים חשוב החיוני לייצור של חומצת האמינו פירוליזין.
חלבונים משמשים בתפקידי מפתח בתהליכים חיוניים רבים ביצורים חיים: הם מעבירים חומרים ממקום למקום, מזרזים תגובות כימית, "שואבים" יונים או מזהים מולקולות איתות. המורכבות והמגוון של החלבונים הינם כבירים, כאשר בגוף האדם עצמו לבדו קיימים יותר ממאה אלפי חלבונים שונים. ועדיין, כמעט כולם מורכבים מעשרים חומצות אמינו בלבד. רק במספר חלבונים בעלי מומחיות גבוהה במיוחד מופיעות גם חומצת האמינו העשרים ואחת הנדירה, סלנוציסטאין (selenocysteine) שהתגלתה רק בשנת 1986.
הפתעה גדולה הייתה גם הגילוי של חומצת האמינו העשרים ושתיים בשנת 2002 בחיידקים קדומים (או ארכאונים) מייצרי-מתאן: פירוליזין. חומצה זו מקודדת גנטית באופן דומה לשאר חומצות האמינו. חיידקים אלו משתמשים בחומצת האמינו הנדירה הזו עבור חלבונים הנדרשים להם לתהליכי המרת אנרגיה. פירוליזין ממוקם במרכז הקטליטי של החלבונים והוא חיוני לתפקודם – תהליך הפקת האנרגיה בחיידקים אלו לא יתרחש ללא חומצת האמינו הזו.
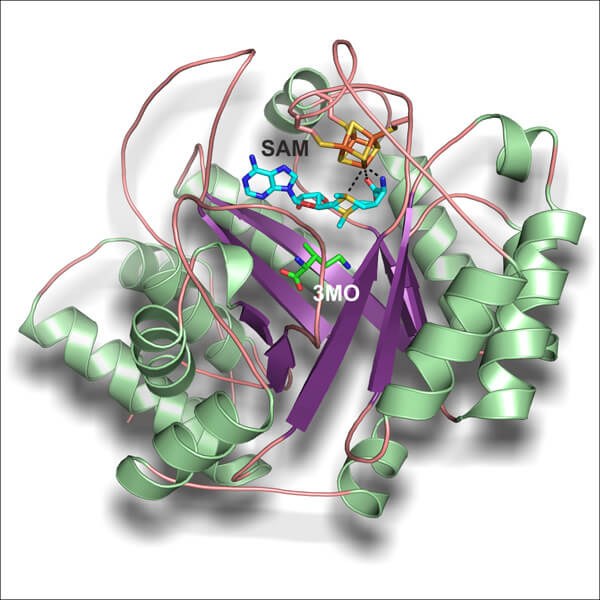
בחודש מארס 2011, מדענים מאוניברסיטת אוהיו הצליחו לפענח חלקים מתהליך הייצור של הפירוליזין. הם הציעו מנגנון תגובה שבו אנזים ספציפי מקטלז את השלב הראשון של ביו-הסינתזה של הפירוליזין באמצעות המרת חומצת האמינו ליזין לתוצר הביניים metyhlornithin. בשלב הבא החוקרים הצליחו לקבוע את מבנהו הגבישי של האנזים הזה באמצעות אנליזת קרני-רנטגן.
לתדהמתם, הם הצליחו לצפות באנזים ב"שעת הפעולה" עצמה: ברגע התגבשות תוצר התגובה, metyhlornithin, כאשר הוא עדיין לא השתחרר מהאזנים. "המצב שבו התוצר עדיין היה אחוז באנזים מהווה ממצא מיוחד וממוזל ביותר," אומר אחד מהחוקרים. "לא רק שהצלחנו לזהות ישירות את תוצר הביניים, אלא שהתאפשר לנו להסביר בדיעבד את היווצרותו של חומר זה מחומצת האמינו המקורית ליזין."
לא רק שתגובה זו לא הייתה ידועה עד כה, אלא שקשה מאוד היה לזרז אותה. צבר של ארבעה אטומי ברזל וארבעה אטומי גופרית באתר הפעיל הוא הבסיס לתהליך ההמרה. "זוהי באמת תגובה קטליטית בלתי-רגילה. עד עתה אף כימאי באף מעבדה לא הצליח לסנתז את חומר-הביניים (methylornithine) בתגובה חד-שלבית מתוך ליזין," מסביר החוקר הראשי.
הבנת תהליך ההמרה של ליזין ל- methylornithine מסייעת למדענים להבין כיצד חיידקים קדמונים יכולים להתאים מערכת קיימת להכנת חומצת אמינו חדשה ונדרשת, כאשר מטמיעים אותה בחלבון מתאים תוך קטליזה של תגובה מוגדרת במיוחד. החוקרים יוכלו להשתמש בידע חדש זה על מנת ליצור חומצות אמינו מלאכותיות לשם יצירת אנזימים מותאמים אישית בעלי תכונות מיוחדות, שיוכלו, לדוגמה, לשמש במגוון יישומים בתחומי הביוטכנולוגיה והרפואה.
הידיעה על המחקר

2 תגובות
הקוד הגנטי זהה לכל היצורים. הפירוליזין מקודד ע"י קודון העצירה, UAG.
ביצורים שלא אמורים להשתמש בפירוליזין, כלומר אלו שלא מייצרים מתאן, חסר האנזים הדרוש ליצירת הפירוליזין, וה-UAG נקרא כקודון עצירה. כשהריבוזום מגיע אליו, סינתזת הפפטיד נעצרת.
בארכיאה שמייצרים מתאן קיים האנזים שיוצר פירוליזין, לכן קיים גם tRNA שקשור לפירוליזין. כשהריבוזום שלהם מגיע ל-UAG שנמצא עם רצף נוקלאוטידים ש-"תומך" בהכנסת פירוליזין על ה-mRNA, הוא יצרף את הפירוליזין לפפטיד שאותו הוא מסנתז.
בדיקה בטבלת הקוד הגנטי מראה שהחומצה האמינית פירוליזין לא מקודדת בניגוד למה שניכתב כאן :http://en.wikipedia.org/wiki/Genetic_code
האם המשמעות היא שהקידוד הגנטי שלה מופיע רק באותם חיידקים ,או שבאותם חיידקים יש פשוט המרה מאוחרת יותר של ליזין בלי קשר לקידוד הגנטי ?