סרטונים חדשים, המצולמים בחשיפה של מיליוניות של מיליארדית השנייה, מתעדים תרופות חלבוניות או תהליכי פוטוסינתזה תוך כדי פעולה – או תוך כדי כישלון בפעולתן
מאת פטרה פרום, ג’ון ס’ ה’ ספנס, הכתבה מתפרסמת באישור סיינטיפיק אמריקן ישראל ורשת אורט ישראל 06.07.2017
- חלבונים מצויים בתנועה מתמדת, ותוך כדי כך הם יוצרים תגובות כימיות המאפשרות קיום של חיים. תנועה זו מתרחשת בקנה מידה קטן כל כך ובמהירות גבוהה כל כך עד שגם באמצעות מיקרוסקופ אי אפשר לעקוב אחריה.
- אנשי מחקר משתמשים בלייזר קרני-x הפולט הבזקים קצרים ביותר, הנמשכים מיליוניות של מיליארדית השנייה, כדי להפיק סרטונים המציגים מולקולות בפעולה ומדגימים כיצד משתנה המבנה של חלבונים במהלך תגובה כימית בין המולקולות.
- סרטונים אלה יכולים לתעד תגובות כימיות בין מולקולות ביולוגיות בפירוט חסר תקדים ולהראות מדוע, לעתים, תרופות אינן פועלות על חלבוני מטרה ואיך תהליך הפוטוסינתזה בצמחים יוצר אנרגיה נקייה.
עמוק מתחת למרגלות ההרים, סמוך לפאלו אלטו שבקליפורניה, במעבדה תת־קרקעית, מיהרו המדענים לסיים את ההכנות האחרונות לסדרה של פיצוצים. הניסוי שתכננו, פיצוץ גבישים זעירים של חלבונים, היה עשוי לחשוף את אחד הסודות השמורים ביותר של הטבע – סוד ההמרה של האור לאנרגיה כימית בתהליך הפוטוסינתזה בצמחים. התועלת הפוטנציאלית: התקדמות לקראת גילוי מקור בלתי מוגבל של אנרגיה נקייה.
זה היה בדצמבר 2009, שעה שצוות של אנשי מחקר וסטודנטים טרוטי עיניים עשה לילות כימים במעבדת מאיץ החלקיקים הלאומית האמריקנית שבאוניברסיטת סטנפורד (SLAC) כדי להכין את הניסוי שאמור היה להיערך בלייזר של קרני-x (קרני רנטגן). במתקן הזה, הידוע בשם “מקור אור קוהרנטי במאיץ קווי” (LCLS), שהוא המתקן רב העוצמה ביותר מסוגו בעולם, מאיצים אלקטרונים למהירויות הקרובות מאוד למהירות האור. אחת הקבוצות בצוות עסקה בקדחתנות בכוונון ההתקנים שהיו מיועדים לירות את גבישי החלבונים לתוך אלומת קרני ה-x. קבוצה אחרת טענה את התקני הירי בגבישים של תצמיד חלבונים המכוּנה מערכת אור I, אחד השחקנים החיוניים בפוטוסינתזה.
בסופה של מנהרת מאיץ החלקיקים, שאורכה יותר משלושה קילומטרים, החלו הגבישים את מסעם לעבר אור הלייזר העז. אך עוד קודם שכל אחד מהם התפוצץ, הוא תועד בטכניקה מדעית חדשנית, בכעין תצלום בזק. שיטה זו טומנת בחובה הבטחה לעתיד ופותחת לנו פתח להבנת תהליכים ביולוגיים המתרחשים בקנה מידה זעיר ביותר, שכן היא מאפשרת לנו לקבל סדרה של תמונות בזק כאלה, בהפרשים של פֶמְטוֹ-שניות, או מיליוניות של מיליארדית השנייה (10-15 שניות), ולארגן אותן ברצף לכלל סרטון שלם.
הפיזיקאי ריצ’רד פיינמן אמר פעם: “אפשר להבין את כל מה שיצורים חיים עושים במונחים של אטומים מתנועעים ומתנודדים.” אך מעולם קודם לכן לא יכולנו לחזות באופן ישיר בתנועתם המהירה כל כך של אטומים ומולקולות בגוף החי. השיטה שפיתחנו, המכונה קריסטלוגרפיית פֶמְטוֹ-שניות סדרתית (SFX), מאפשרת לנו לצפות בתנועות “הריקוד” הסוּפּר-מהירות של מולקולות, הקובעות, בין השאר, כיצד תרופות משפיעות על תאים חולים ואיך תגובות כימיות ממירות אנרגיה כימית לצורות אחרות של אנרגיה.
צוותי מחקר ברחבי העולם כבר נעזרים ב-SFX, ובזכות השיטה הצליחו מדענים לחשוף את פרטי הפרטים של התהליך שבו תרופה ניסיונית מווסתת את לחץ הדם, וכך סללו את הדרך לפיתוח תרופות יעילות יותר לטיפול בלחץ דם גבוה. באמצעות SFX התגלה גם המבנה של אנזים המשמיד תאי דם אדומים של חולים במחלת השינה, מחלה קטלנית הנגרמת על ידי טפילים. השיטה אפשרה לראשונה גם צפייה בשלבים התחיליים של הפוטוסינתזה, שבהם מולקולות מים מתפצלות למימן ולחמצן.
אך ב-2009, באותה מעבדה תת־קרקעית, כשהבזקים (פּוּלְסים) של קרני-x החלו להשמיד את הגבישים שערכנו בקפידה לקראת הניסוי, עתידנו המקצועי היה מונח על כף המאזניים. באותם ימים טענו מדענים רבים ששיטת SFX לעולם לא תעבוד, וכל בקשותינו למימון המחקר נדחו. אלא שאז הופיעו פתאום על צגי המחשבים במעבדה תמונות יפהפיות של פיזור קרני-x. אנחנו עדיין זוכרים, כאילו היה זה היום, איך פרצנו בקריאות שמחה נלהבות כשצפינו בלידתו של מה שעתיד היה להתגלות כתחום מדעי חדש של שימוש בקרני X.
חזון קרני ה-x
עוד לפני שפיתחנו את שיטת SFX, רשמו לזכותם מדענים הישגים מדהימים כשהצליחו לגלות שינויים במבנים כימיים מסוימים, אך באותה עת הם לא היו יכולים לצפות בפועל במבנים הביולוגיים המורכבים והעדינים ביותר תוך כדי פעולתם. לשם דוגמה, בשנות ה-80, פיתח הכימאי המנוח, חתן פרס נובל, אחמד ח’ זוויל, שיטה למעקב אחר תנועתם של אטומים במהלך תגובות כימיות, וזאת, באמצעות הבזקים מהירים מאוד של לייזר באור נראה. אך אורך הגל של אור נראה ארוך מכדי לאפשר צפייה בפרטי המבנה הזעירים ביותר של חלבונים. וזה לא מכבר, התקדמות דרמטית בתחום הטכנולוגיה המיקרוסקופית הניבה תמונות של חלבונים ונגיפים ברזולוציה קרובה לרזולוציה אטומית. אלא שתמונות אלה אינן מתקבלות בקצב גבוה דיו כדי ללכוד תגובות כימיות המתרחשות במהירות הבזק, כגון אלה המתרחשות בפוטוסינתזה.
החלטנו אפוא להשתמש בקרני-x, המספקות מהירות ורזולוציה גבוהות דיין לתיעוד תגובות כימיות בין מולקולות ביולוגיות תוך כדי התרחשותן. המפתח לעבודתנו היה פיתוח טכנולוגיה שתאפשר לנצל את קרני ה-x כדי לקבל תצלומי בזק של המולקולות בשבריר השנייה לפני שאותן קרניים הורסות את המולקולות. מדענים העוסקים במחקר בתחום הזה בשיטה המסורתית נוהגים להשקיע מאמצים רבים בגידול גבישים גדולים של חלבונים ומולקולות אחרות במטרה למפות את מיקומי האטומים במולקולות. בשלב הבא, הם חושפים את הגבישים לאלומת קרני-x ומתעדים את דגם הפיזור או העקיפה של הקרניים כשהן פוגעות בגבישים. המולקולות בגבישים ערוכות בסדר פנימי אחיד, במבנה בסיסי החוזר על עצמו, כך שקרני ה-x הפוגעות בהן מתפזרות בדרכים צפויות, מה שמאפשר למדענים לקבוע את מיקומי האטומים וזהותם על פי דגם הפיזור. שיטה זו נקראת קריסטלוגרפיית קרני-x. השיטה שפיתחנו, קריסטלוגרפיית פמטו-שניות סדרתית, מבוססת על עיקרון זהה, אך מאפשרת צפייה במבנה האטומי במהירות גבוהה הרבה יותר.
אבל בסופו של דבר, קרני-x הורסות את המולקולות שבהן אנחנו מעוניינים לצפות. ההנחה המקובלת הייתה שלייזר קרני-x, הממקד קרני-x בעלות אנרגיה גבוהה באלומה רבת־עוצמה, רק יחמיר את מצב העניינים. האור הבהיר של הלייזר לבדו יכול לנקב חור בפלדה. אם כך, היה פשר להניח שמולקולה ביולוגית שברירית תהיה חסרת כל סיכוי לשרוד בתנאים אלה. היה עלינו למצוא דרך להקדים וללכוד תמונה בטווח זמן של פמטו-שניות לפני שהנזק הצפוי מקרני ה-x יתרחש. לשם השוואה, ההבדל בין פמטו-שנייה אחת לבין שנייה שלמה אחת שקול להבדל שבין שנייה אחת לבין 32 מיליון שנים.
המפתח לשיטת SFX טמון באותו חלקיק זמן קצרצר במידה בלתי נתפסת שבין הרגע שבו הבזק הלייזר פוגע במולקולה לבין הרגע שבו אנרגיית הלייזר קורעת את האלקטרונים מן האטומים שלהם במולקולה. ללא אלקטרונים, השאריות הטעונות במטען חיובי דוחות זו את זו והמולקולות מתפוצצות.
וכך השיטה פועלת: תחילה, אנחנו גורמים לתגובה כימית בין המולקולות במטרה ליצור גביש זעיר. לאחר מכן, אנחנו יורים לעבר הגביש אלומת קרני-x בעלת עוצמה גבוהה ביותר בהבזק קצר מאוד, אך ארוך דיו כדי לאפשר פיזור של מקצת קרני ה-x עם פגיעתן בגביש, ממש לפני שאנרגיית האלומה מפרקת את המולקולות. גלאי לוכד את תמונת הפיזור של קרני ה-x ועל פי צורתו אנו מסיקים מהו סוג האטומים בחלבון הנבדק ומהו מיקומם. לכידת תמונות של זרם גבישי חלבון תוך כדי מעברם בזוויות שונות דרך אלומת קרני ה-x, מאפשרת לנו לשחזר את המבנה התלת-ממדי של החלבון. ולבסוף, ביכולתנו לסדר ברצף סדרת תמונות המתקבלות בנקודות זמן שונות במהלך תגובה כימית ולהפיק כעין סרטון המתעד את המולקולות תוך כדי פעולה.
תצוגה מגובשת
הצעד הראשון לקראת הפקתם של סרטונים כאלה המתעדים מולקולות בפעולה נעשה בשנת 2000 כשהביו-פיזיקאים יאנוש האג’דו וריצ’רד נויטשה, שפעלו אז באוניברסיטת אופסלה שבשוודיה, חישבו ומצאו שטווח הזמן מרגע פגיעת קרני ה-x במולקולות עד לרגע שבו הן מתחילות להתפוצץ הוא כ-10 פמטו-שניות. מדענים זקוקים אפוא ללכוד תמונה בפרק זמן קצר מזה. ב-2006 הצליחו הנרי צ’פמן, העוסק כיום במחקר במאיץ האלקטרונים הגרמני DESY, ועמיתיו לעשות בדיוק זאת. הם פעלו בגישה של “פיזור ואז פירוק” כדי ללכוד צילום ברזולוציה נמוכה של תמונה זעירה שנצרבה על גבי משטח של סיליקון-ניטריד (Si3N4) ובה נראות שתי דמויות אדם והשמש המאירה עליהם.
אך האם שיטה זו עשויה להתאים גם לדימות של מולקולות ביולוגיות עדינות? כשהצענו לנסות את השיטה, הייתה הקהילה המדעית ספקנית רובה. עשר הבקשות הראשונות שהגשנו לקבלת מענקי מחקר נדחו כולן. הספקנים טענו שההבזקים הנפלטים מלייזר קרני-x אינם קצרים די הצורך, שגבישי החלבון קטנים מכדי להחזיר אותות כלשהם הניתנים לזיהוי, או שלעולם לא נוכל לדעת מהו מִכְוון הגביש בעת שהבזק קרני ה-x פוגע בו – מידע חיוני לקביעת מבנה הגביש.
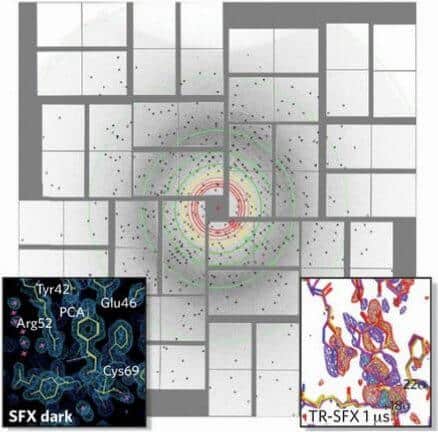
אך אנחנו סברנו שאם אפשר לצלם מולקולות מסוגים אחרים, כפי שהראה צ’פמן, יהיה אפשר לצלם גם מולקולות ביולוגיות. אחת מאתנו (פטרה פרום) וחברי הצוות שלה ביקשו להוכיח את היעילות של SFX באחד הניסויים הקשים ביותר לביצוע שניתן להעלות על הדעת: עם גבישי מערכת אור I. תצמיד החלבונים הזה, המורכב מ-36 חלבונים ויותר מ-300 צבענים (פיגמנטים) ירוקים וכתומים לוכדי אור, הוא אחד המבנים החלבוניים המורכבים ביותר שעברו אי פעם אנליזה באמצעות קרני-x.
פרום הכירה את המבנה של מערכת אור I בפרטי פרטיו, שכן במשך שנים קודם לכן, היא עסקה ביצירת גבישים של התצמיד החלבוני הזה ובקביעת מבנהו בשיטות אחרות. וכולנו, כל חברי קבוצת המחקר, חשבנו שממדיו הגדולים באופן יחסי של התצמיד הביו-מולקולרי יוכלו דווקא להיות ליתרון משום שגם על סמך מספר קטן של דגמי פיזור, נוכל לקבל תמונה, גם אם ברזולוציה נמוכה, שבה יהיה אפשר לזהות את מערכת אור I. וזה אכן מה שהצלחנו לבצע באותה מעבדה תת־קרקעית ב-2009.
קטן הוא יפה
כדי ללכוד את תמונת הבזק המבוקשת, היה עלינו להכין תחילה מאגר של גבישי מערכת אור I. בדרך כלל, מדענים העוסקים בקריסטלוגרפיה מגדלים גבישים גדולים כדי לקבל פיזור של קרני-x שדי בו כדי לשחזר את מבנה החלבון. אלא שבחלבונים מסוימים, תהליך הגידול של גבישים כאלה המצטיינים בסדר הפנימי האחיד שלהם עלול להצריך שנים ארוכות של ניסויים. וכפי שהוכח, התהליך כמעט אינו ישים לגבי כמה מן החלבונים האלה, ובהם מערכת אור I.
במקום זאת, בשיטת SFX נעשה שימוש בגבישים בסדרי גודל נָנוֹ-מטרי (10-9 מטר), שהרבה יותר קל לגדלם במעבדה. אבל השימוש בגבישי-ננו הציב בפנינו אתגרים חדשים. היה עלינו לא רק להבטיח קבלת אות חזק די הצורך מגביש זעיר כל כך, אלא להתגבר גם על כמה קשיים טכניים בסיסיים: איך נוכל לזהות גבישי-ננו זעירים כל כך עד שאי אפשר לצפות בהם במיקרוסקופ? ואיך בכלל נוכל למקם גבישים כאלה מול הבזקים של קרני-x ואף לעשות זאת בעקביות 120 פעמים בשנייה?
ובכן, תחילה היה עלינו לפתח דרכים חדשות לצפייה בגבישי הננו שלנו. אחת השיטות שיישמנו נקראת SONICC(דימות לא לינארי מסדר שני של גבישים כִּירָלִיים), שבה הגבישים ממירים שני הבזקים מהירים מאוד של אור אינפרה-אדום לפוטון יחיד של אור ירוק. אגב כך, גבישי הננו מאירים וזוהרים כגחליליות בלילה, מה שמאפשר לנו לצפות בהם ולזהות אותם.
בשיטה אחרת שפיתחנו, אנו יורים את הגבישים לתוך אלומת קרני ה-x בזה אחר זה, בקצב אחיד ומהיר. אחד מחברי הצוות שלנו (ספנס), יחד עם שני פיזיקאים מן האוניברסיטה של מדינת אריזונה, יוּוי ויירסטול וברוס דואק, בנו התקן הפועל בדומה למדפסת הזרקת דיו שיורה סילון של תמיסת גבישי-ננו דרך אלומת קרני ה-x. התקן ההזרקה הזה יורה את גבישי הננו בדיוק כה רב, עד כי נראה כאילו הם צועדים לתוך האלומה כחיילים בשורה.
כדי למנוע סתימה של התקן ההזרקה וחסימת זרם גבישי הננו, נדרש ויירסטול לתכנן נחיר רחב, עם זאת גם בעל יכולת להעביר סילון צר של גבישי-ננו. לשם כך, הוא הזרים גז הליום סביב צִדו החיצוני של הנחיר. הגז מיקד את סילון הגבישים לממדים זעירים ביותר, עד כדי חלקיק קטנטן מעובי שערה של אדם, שעה שקוטר הנחיר נותר גדול ביותר מפי עשרה.
לאחר שהכנו את כל הציוד הנדרש לניסוי, ניצבנו בפני בעיה נוספת: איך להתמודד עם הררי הנתונים. ניסוי אחד בלבד יכול לייצר לא פחות מ-100 טֵרָה-בייט של נתונים, די כדי למלא את הכוננים הקשיחים של 25 מחשבים שולחניים משוכללים ביותר. וכדי ליצור תמונה תלת־ממדית, היה עלינו למצוא את המכוון המדויק של כל אחד מן הגבישים בעשרות אלפי תמונות הבזק ולארגן את כולן ברצף כך שנוכל לראות את התמונה בשלמותה. פיתחנו אפוא תוכנה מיוחדת, בשיתוף פעולה עם ריצ’רד קיריאן ותומס וייט, שבאותה עת היו חברים בצוות של צ’פמן ב-DESY, המאפשרת לנו לעבד את שטף הנתונים האדיר ולהפיק ממנו תמונות תלת־ממדיות מדויקות של מולקולה.
וכך, צעד אחר צעד, שכללנו את השיטה שלנו. ובזכותה, ב-2014 יכולנו לצפות לראשונה בזמן אמת בחילופי אלקטרונים בין שני שחקני מפתח בתהליך הפוטוסינתזה: תצמיד החלבונים הגדול הלוכד את אור השמש, מערכת אור I, וחלבון בשם פרדוקסין.
כשקרני האור פוגעות במערכת אור I, האנרגיה שלהן מעבירה את אלקטרונים אל הפרדוקסין הנושא אותם הלאה לשימוש בתהליך המרת הפחמן הדו־חמצני (CO2) למולקולות ביולוגיות. כשהפרדוקסין מסיים את תפקידו במערכת העברת האלקטרונים ומפנה את הזירה, גבישי החלבון ניתכים במהירות, מה שמקשה על מעקב אחר התגובה הכימית. רק בשיטת SFX הסוּפּר-מהירה אפשר לצפות בשינויים המתרחשים במהירות הבזק.
האתגר הבא שלנו בקו המחקר הזה, ואחד הנושאים העיקריים שבהם מתמקדת פרום בעבודתה כביו-כימאית הוא הניסיון לגלות איך הצמח מפצל מולקולות מים למימן ולחמצן בעזרת אור השמש ומתכות נפוצות. פיצול מולקולות מים באופן שבו נעשה הדבר בצמחים עשוי לספק מקור דלק מימני זול ונקי למכוניות ולתחנות כוח ולאפשר את מימוש החלום הוותיק לפיתוח כלכלה המבוססת על אנרגיה מתחדשת.
הסרטונים שאנחנו מפיקים באמצעות SFX יכולים לסלול את הדרך לא רק לפריצות דרך עתידיות, אלא גם, בעתיד הקרוב יותר, לפיתוח תרופות טובות יותר.
כשאספנו את התמונות הראשונות ברזולוציה נמוכה של תהליך פיצול מולקולות המים, ראינו רמז ראשוני לשינויים מבניים משמעותיים בתצמיד החלבוני המעורב בתהליך, מערכת אור II. וממש לאחרונה, קבוצת מחקר בראשותו שלג’יאן-רן שן מאוניברסיטת אוקיאמה ביפן שיישמה את שיטת SFX קיבלה תמונות מפורטות עוד יותר של התהליך. מטרתנו עתה היא להפיק תמונות ברזולוציה גבוהה ולארגן אותן ברצף בסרטונים שיראו בפירוט את כל השלבים בתהליך, ברמה האטומית, וכך לחשוף את סוד הפוטוסינתזה.
תרופות ממוקדות מטרה
עתה, לאחר שמדענים החלו ליצור סרטונים באמצעות SFX, סרטונים אלה יכולים לסלול את הדרך לא רק לפריצות דרך עתידיות, אלא גם, בעתיד הקרוב יותר, לפיתוח תרופות טובות יותר. ראינו את הפוטנציאל הטמון בהם כשעסקנו בחקר חוסמי הקולטן לאנגיוטנסין (II (ARBs . תרופות אלה חוסמות את קולטן תאי ההורמון אנגיוטנסין II, הורמון הגורם לכיווץ כלי הדם ולעלייה בלחץ הדם. חוסמי הקולטן משמשים לטיפול בלחץ דם גבוה, הגורם העיקרי לשבץ מוחי ולאי ספיקת לב בארה”ב. ואם כי הדור הראשון של תרופות אלה הוכח כיעיל, הרי שהתרופות נקשרות לקולטני המטרה שלהן באופן חלש בלבד ויש ליטול אותן במינונים גבוהים, מה שמחמיר את תופעות הלוואי שלהן, הכוללים, בין השאר, כאבי ראש וסחרחורות ולעתים אף בעיות חמורות יותר, כגון נפיחות בפנים ובצוואר.
במחקר שערכנו גילינו מהי הסיבה לקשר הרופף שנוצר בין התרופות לקולטני המטרה: מתברר שהתרופות אינן מותאמות היטב לקולטן כפי שהיו אמורות להיות, כך שרבות מן המולקולות שלהן אינן ממלאות את תפקידן. על סמך מבנים מדויקים יותר של הקולטנים נוכל לפתח תרופות ARB שיהיו יעילות יותר בוויסות לחץ הדם. למעשה, תרופה אחת כזאת המכוּנה ZD7155 מצויה כיום בשלב הערכה.
ככל שיהיה בידינו מידע מפורט ומדויק יותר כן נוכל לפתח תרופות יעילות יותר. הקולטנים לאנגיוטנסין II שייכים לקבוצה רחבה וחשובה ביותר של קולטנים תאיים הקרויים קולטנים מצומדים לחלבון G. מולקולות אלה המשובצות בקרום התא מאפשרות לתא לחוש ולהגיב לסביבתו. המדענים שפענחו לראשונה את מבנה הקולטנים בקבוצה זו ואת מנגנון הפעולה שלהם, רוברט לפקוביץ’ ובריאן קובילקה, זכו בפרס נובל בכימיה לשנת 2012 על התגלית פורצת הדרך. בשל התפקיד החיוני שממלאים הקולטנים המצומדים לחלבוני G בגדילה ובהישרדות של תאים, נחשבים קולטנים אלה למטרות מפתח לתרופות חדשות. היכולת לִצְפות בשינויים שעובר המבנה שלהם תסייע לכימאים העוסקים בפיתוח תרופות לתכנן תרופות המותאמות לקולטנים ונקשרות אליהם באופן מושלם, וכך למנוע או לצמצם תופעות לוואי אפשריות.
“הראינו שכל המודלים המולקולריים הקודמים שלפיהם שיערנו איך קולטן ותרופה נקשרים היו שגויים בפרטים חשובים רבים,” אומר ואדים צ’רזוב מאוניברסיטת דרום קליפורניה, שהוביל את ניסוי האנגיוטנסין II. לשם דוגמה, בשיטת ה-SFX התגלה שמבנה הקולטנים המצומדים לחלבוני G בטמפרטורת החדר שונה מן המבנה שלהם בטמפרטורות קְרִיּוֹגֵנִיות, נמוכות מאוד, המשמשות באופן מסורתי בקריסטלוגרפיה. משמעות הדבר היא שתרופות המיועדות לפעול על קולטני מטרה שפותחו בטמפרטורות נמוכות ביותר שמתחת לנקודת הקיפאון לא יפעלו כנדרש בסביבה החמה של גוף האדם. (לעתים, תרופות פועלות על מולקולות מטרה רבות יותר מאלה המיועדות להן. זו, למשל, הבעיה עם תרופות המיועדות לטיפול במחלת השינה. הסרטונים שהפקנו מראים שהתרופות פועלות באופן דומה גם על חלבונים שמקורם בטפיל מחולל המחלה וגם על חלבונים בתאי גוף האדם. התמונות המדויקות יותר שקיבלנו מסייעות לכימאים לפתח תרופות המשפיעות על חלבוני הטפיל בלבד, ולא על חלבונים בגוף האדם.)
סוד הראייה
אנחנו נרגשים לראות איך אנשי מחקר אחרים מיישמים את שיטת SFX שפיתחנו כדי לפענח כמה וכמה תעלומות מדעיות אחרות. מריוס שמידט מאוניברסיטת ויסקונסין-מילווקי ועמיתיו נעזרו לאחרונה בסרטונים המתעדים פעילות מולקולרית כדי להסביר איך פועל מנגנון הראייה. בדרך כלל, איננו מייחסים לחיידקים כושר ראייה, אך מתברר שהם מצוידים בחלבונים קולטי אור שהם המבשרים האבולוציוניים של אלה שבמערכת הראייה שלנו. על ידי לכידת תצלומי בזק במהירות גבוהה יותר מאי פעם, הצליח צוות המחקר של שמידט להפיק סרטון וידיאו המראה בהילוך אִטי אירועים המתרחשים במהירות הבזק, בשברירי שנייה, ומגלה איך החלבון החיידקי חש באור ומגיב לו.
צוות המחקר השתמש ב-SFX כדי ללכוד תמונות של גבישי החלבון כשהם קולטים את האור ומגיבים לו במרווחי זמן של פחות מטריליונית השנייה. הצוות עסק, באופן ספציפי, במיפוי האטומים של החלבון תוך כדי תנועה כשמולקולת צבע הטמונה בחלבון הפכה לצהובה בתגובה לאור. זו הייתה הפעם הראשונה שבה הצליחו מדענים ללכוד את מבנה מולקולת הצבע הצהובה מיד לאחר שקלטה את האור ועוד קודם שהגיבה לו. שלב זה חיוני לקליטת האור בכל היצורים החיים, לרבות חיידקים וצמחים, והוא גם השלב הראשון בתהליך הראייה בבני אדם.
צפייה באופן שבו חלבונים קולטי אור אלה מגיבים לאור מסייעת לנו להבין איך התפתחה מערכת הראייה ואף, יותר מזה, מאפשרת לנו לעקוב מקרוב, בפירוט חסר תקדים, אחר התגובה בין מולקולות ביולוגיות, המתרחשת בקנה המידה הסוּפּר-מהיר של הכימיה. “הדבר מקדם אותנו בצעדי ענק להבנת התהליכים הכימיים שביסוד כל צורות החיים,” אומר שמידט.
אנו סבורים שעתיד הקריסטלוגרפיה של חלבונים, כמו גם הידע שלנו על הטבע, טמון בשיטת SFX. ומי יודע, אולי בתוך עשר שנים, מחצית מכלל המבנים החלבוניים המוכרים לנו שוב לא יוצגו רק כתמונות סטטיות על דפי ספרי לימוד, אלא יתועדו בסרטונים תלת־ממדיים תוך כדי פעולה.

3 תגובות
נשמע מדהים, והמון מלל, אבל איפה הסרטונים?
למה לא מביאים פה סרטון אחד כזה לדוגמא
למי שתהה למה הפוטוסינתזה זה “אחד הסודות השמורים בטבע” אם כל תלמיד בביולוגיה לומד את התהליך – מה שאומר שהוא לא סוד בכלל, אני יסביר:
התעלומה היא המערכת הספציפית בפוטוסינתזה שקולטת פוטונים ומעבירה למולקולה מרכזית אחת (שם הפוטוסינתזה ממשיכה) – הדיוק והיעילות של המערכת הזאת ספציפית כל כך טובים, שקשה להסביר אותם בכלים ביולוגיים רגילים, ורק על ידי תיאוריית הקוונטים אפשר להסביר אותה, או להתחיל להסביר.